転写因子NRF3による新たな脂質代謝の調節メカニズム解明
コレステロールや脂肪酸などの脂質は脂溶性ホルモンや細胞膜の原料、あるいはエネルギー貯蔵体に使われる非常に重要な物質であり、その代謝異常は肥満や糖尿病、動脈硬化、さらには癌の発症・進展にも関連することが知られています。
再生医学/遺伝情報研究室(遺伝情報研究)の和久剛准教授と小林聡教授は今回、同研究室の所属学生である萩原透、田村奈都子、渥美友里、石見拓也、佐藤克哉らとともに、転写因子NRF3による新たな脂質代謝の調節メカニズムを解明しました(下図)。
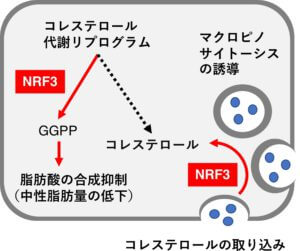
和久准教授らこれまでに、転写因子NRF3が大腸がんをはじめとした様々な腫瘍組織で高発現し、腫瘍増大や転移促進といったがん悪性化を引き起こすことを報告してきました。今回の研究ではまず、NRF3がヒトがん細胞内でどのような役割を担っているのかを明らかにするため、DNAマイクロアレイを用いた網羅的な遺伝子発現解析を行いました。その結果、NRF3がコレステロール前駆体であるメバロン酸の生合成と関連することを発見しました。その分子メカニズムを詳細に調べたところ、NRF3は別の転写因子であるSREBP2と複合体を形成することで、メバロン酸・コレステロール生合成の律速酵素であるHMGCRの転写を協調的に誘導していることを見出しました。次にシステム生命科学研究室の浦野泰臣准教授・野口範子教授と共同でコレステロール関連代謝物を定量した結果、予想外にNRF3はコレステロールを生合成せず、ゲラニルゲラニル二リン酸(GGPP)という別の物質を産生する方向へと代謝をリプログラムしている可能性を見出しました。さらにGGPPは脂肪酸の合成を抑制することで、細胞内の中性脂肪量を低下させていることを明らかにしました。またNRF3はマクロピノサイトーシスと呼ばれる基質非特異的なエンドサイトーシスを誘導することで、細胞内のコレステロール量を一定に保っていることも明らかにしました。最終的には東北大学医学系研究科の鈴木未来子准教授・山本雅之教授と共同でNRF3トランスジェニックマウスを作成し、生体内においても上述した遺伝子がNRF3依存的に転写誘導されることを確認しました。以上の知見は、NRF3が脂質代謝を調節することで中性脂肪量の増加や腫瘍の増大を引き起こす、すなわちNRF3は肥満とがん悪性化をつなぐキーファクターである可能性を強く示しています。
論文タイトル: NRF3 upregulates gene expression in SREBP2-dependent mevalonate pathway with cholesterol uptake and lipogenesis inhibition
doi: https://doi.org/10.1016/j.isci.2021.103180.
著者:Tsuyoshi Waku, Toru Hagiwara, Natsuko Tamura, Yuri Atsumi, Yasuomi Urano, Mikiko Suzuki, Takuya Iwami, Katsuya Sato, Masayuki Yamamoto, Noriko Noguchi, Akira Kobayashi (equal contribution)