肥満はがんや糖尿病、動脈硬化など様々な病気の発症・進行リスクを高める一方で、肥満患者の予後は良好となる傾向にあることが報告されています。このような矛盾は「肥満パラドックス」として知られています。しかし「肥満パラドックス」は実験的に再現するのが難しいため、その原因となる遺伝子や仕組みについては不明な点が多く残されたままでした。
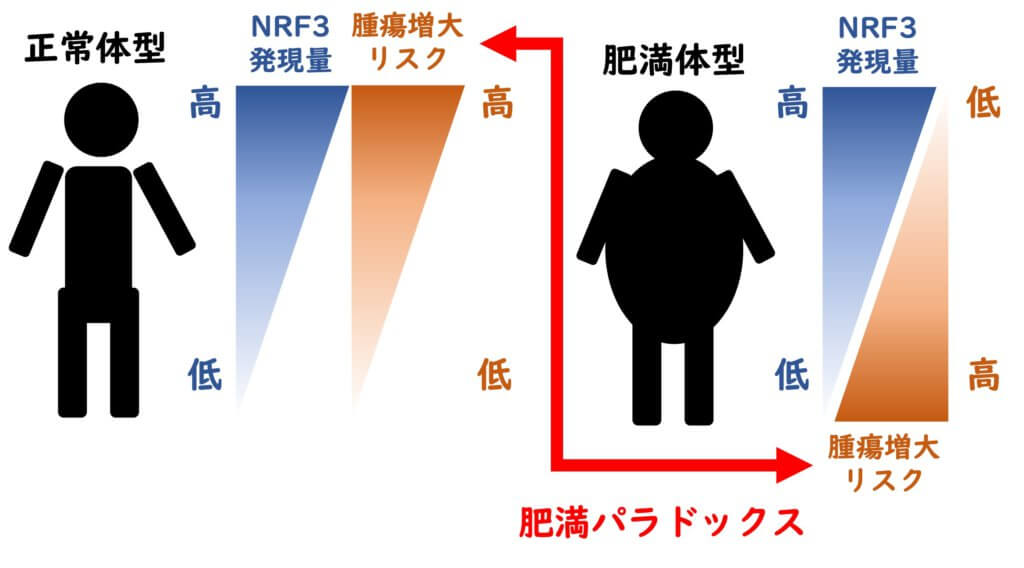
再生医学/遺伝情報研究室(遺伝情報研究)の和久剛准教授と小林聡教授は今回、同研究室の所属学生である石見拓也、増田遥、廣瀬修平、明田伊鳳とともに、転写因子NRF3の発現量と腫瘍増大リスクに肥満パラドックスが生じることを発見しました(右図)。
再生医学/遺伝情報研究室(遺伝情報研究)ではこれまでに、転写因子NRF3が多くのがん患者の腫瘍組織で高発現していることを公共のヒトがんデータベースから発見し、NRF3が実際に腫瘍増大や転移促進を引き起こすことをがん細胞のマウス移植実験で検証してきました。今回の研究では、NRF3による腫瘍形成に肥満が及ぼす影響を調べるため、通常食を与えた正常マウスと高脂肪食を与えた肥満マウスを用いました。これまでの知見と同様に、正常マウスへがん細胞を移植すると、NRF3発現低下によって腫瘍サイズが減少しました。その一方で大変興味深いに、肥満マウスへの移植ではNRF3発現低下によって逆に腫瘍サイズが増加することを見出しました。この結果は、正常体型ではNRF3発減量が多いと腫瘍増大リスクが上昇するのに対し、肥満体型ではNRF3発現量が多いと腫瘍増大リスクが低下すること示しています。この仕組みを解明するため、次に移植マウスから腫瘍組織を摘出して網羅的な遺伝子発現解析を行いました。その結果、脂肪細胞分化に関連する遺伝子群の発現が正常-肥満マウス間で逆転することを発見しました。そこでがん細胞を肥満細胞と共培養したところ、NRF3発現低下によるがん細胞の増殖抑制は肥満細胞との共培養で消失することを明らかにしました。以上の知見は、NRF3が「がんの肥満パラドックス」の責任因子であること、および肥満に伴って増加する脂肪細胞が重要な役割を担っていることを強く示唆しています。
研究内容の詳細は以下の関連情報をご覧ください。
- タイトル: Nrf3 functions reversely as a tumorigenic to an antitumorigenic transcription factor in obese mice
- 著者:Tsuyoshi Waku*, Takuya Iwami*, Haruka Masuda*, Shuuhei Hirose†, Iori Aketa†, Akira Kobayashi (*equal contribution,†equal contribution, Corresponding author: A. Kobayashi )
- 雑誌: The Tohoku Journal of Experimental Medicine, (2023) 259: 1-8
- DOI: https://doi.org/10.1620/tjem.2022.J090